بدايات قصة الكم المثيرة
كيف ظهرت الكمومية في الفيزياء؟
قبل عام 1900، كانت الفيزياء الكلاسيكية تسير قُدمًا في تفسير كل شيء من أصغر الأجسام إلى أكبرها. بل إن عددًا من علماء الفيزياء كانوا على قناعة بأن هذا العلم اقترب من نهايته، وما تبقَّى هو وضع معارفه المختلفة في صورة رياضية مُنمقة، لدرجة أن الفيزيائي الألماني الكبير ماكس بلانك (1858-1947) نُصِح من أساتذته ألَّا يتخصص في الفيزياء، لأن كل ما يمكن أن يُكتشف فيها اكتُشف بالفعل!
لكن هذه النظرة تغيرت في العقود الأولى من القرن العشرين، عندما ظهرت عدد من الألغاز التي وقفت الفيزياء الكلاسيكية عاجزة عن حلها. وللمفارقة، كان بلانك هو من بدأ شرارة الثورة الجديدة التي غيّرت مسار علم الفيزياء، بل غيّرت عالمنا للأبد، فكل أجهزتنا الإلكترونية والرقمية، وأجهزة الليزر بتطبيقاتها المختلفة، ومصادر الطاقة النووية كالمواد المشعة وغيرها، ليست إلا نتاجًا تطبيقيًا لهذا الفرع الجديد في الفيزياء، المسمى بميكانيكا الكم.
بلانك والإشعاع الحراري
بدأت القصة مبكرًا قليلًا في منتصف القرن التاسع عشر، عندما درس الفيزيائي الألماني جوستاف كيرشوف (1824-1887) الإشعاع الصادر عن الأجسام الساخنة.
ولنفهم ما وصل إليه كيرشوف، دعنا نبدأ بمجموعة من التجارب البسيطة: لنضع قطعة حديدية على نارِ موقد لفترة وجيزة. لن نلاحظ أي تغيّر في لون القطعة. إذا أبعدناها عن الموقد، سنكتشف إشعاعًا حراريًا ينبعث منها يمكن الشعور به إذا قَرَّبنا أيدينا، فجلودنا تشعر بالأشعة تحت الحمراء.
لكن بتسخينها أكثر وأكثر، سيتغير لون القطعة إلى الأحمر القاتم ثم الأحمر الزاهي ثم البرتقالي ثم الأصفر ثم الأبيض، وأخيرًا الأزرق.
كما نعرف، فإن الضوء عبارة عن موجات كهرومغناطيسية. وتختلف الأطوال الموجية لألوانه من البنفسجي إلى الأحمر، فموجة الأشعة تحت الحمراء لها أكبر طول موجي، أما موجة الضوء البنفسجي فهي الأقصر.
بيَّنت التجارب الفيزيائية أن الأجسام الساخنة تشع موجات كهرومغناطيسية بجميع الأطوال الموجية، ويكون لكل طول موجي شدة إشعاع مختلفة تعبر عن كمية الطاقة التي يحملها. وجد الفيزيائيون أن الأطوال الموجية الصغيرة تكون شدتها ضعيفة، وتزيد شدة الأشعة كلما زاد طولها الموجي، حتى تصل لأعلى قيمة لها عند الطول الموجي (أو اللون) الظاهر من الجسم الساخن. لكن تبدأ شدتها في النقصان مع الأطوال الموجية الأكبر، حتى تصل الشدة لقيمة صفرية عند الأطوال الموجية الكبيرة جدًا.
حاول الفيزيائيون فهم هذا السلوك لسنوات لكن دون جدوى، فحسابات الفيزياء الكلاسيكية لم تستطع تفسير وجود شدة قصوى للإشعاع، بل بينت أن الشدة لها قيم كبيرة للغاية قرب الأطوال الموجية القصيرة جدًا! لذلك سُميت بالكارثة فوق البنفسجية، نظرًا لقيم الشدة العالية جدًا قرب الطول الموجي للأشعة فوق البنفسجية (طول موجي قصير أو تردد عالٍ) والتي لم تتوافق مع النتائج التجريبية.
لحل هذا اللغز، قدم ماكس بلانك فكرة مبتكرة كانت محورية لفهم فيزياء العالم الصغير، فقد افترض أن طاقة الأشعة المنبعثة من الجسم الساخن هي مضاعفات لقيمة محددة، نسميها اليوم "كَمَّة طاقة/quantum of energy". يمكننا تشبيه الشعاع المنبعث بقطار من عدة عربات، تحمل كل واحدة كمًا معينًا من الطاقة، أو كَمة الطاقة، تعتمد على الطول الموجي للشعاع.
استطاع بلانك أن يفسر باستخدام هذه الفكرة الإشعاع الحراري للأجسام، خصوصًا علاقة شدة الموجات الكهرومغناطيسية بطولها الموجي، ونال عن ذلك جائزة نوبل في الفيزياء عام 1918.
كانت فكرة بلانك غريبة على الفيزيائيين، لأنهم طالما اعتقدوا أن طاقة الموجات الكهرومغناطيسية أو حتى الأجسام قد تأخذ أي قيمة. فالكميات الفيزياء الكلاسيكية كطاقة الجسم مثلًا يمكن أن تكون 5.1 وحدة أو 5.001 وحدة أو 5.00001 وحدة وهكذا. لكن أن تقول إن طاقة الجسم أو الضوء هي مضاعفات لكمية معينة، أي أن الطاقة هي دفقات محددة، فهذا شيء غريب، لذلك اعتقد عدد من الفيزيائيين أن تفسير بلانك قد يكون صحيحًا، لكنه خاص بإشعاع الأجسام الساخنة فقط، ولم يظنوا أن طريقته مفيدة في فهم ظواهر أخرى في الفيزياء.
لغز التأثير الكهروضوئي وآينشتاين
جاءت المفاجأة عندما تقدم فيزيائي غير معروف يعمل في مكتب براءات الاختراعات السويسري بحل للغز آخر صعب، مستخدمًا نفس أفكار بلانك. كان هذا الشاب هو ألبرت آينشتاين الذي فسر ظاهرة "التأثير الكهروضوئي/photoelectric effect" في ورقة علمية له عام 1905.
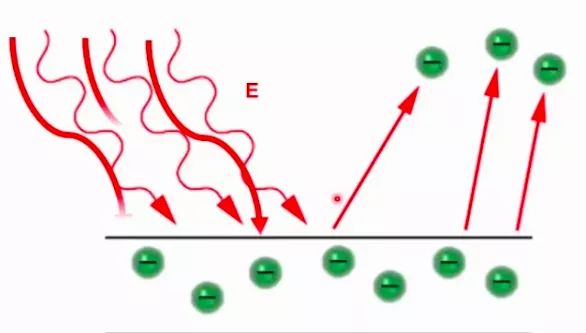
التأثير الكهروضوئي هو ظاهرة انبعاث إلكترونات من سطح معدني عند تعرضه للأشعة فوق البنفسجية ذات الطول الموجي القصير. يمكن استقبال هذه الإلكترونات المنبعثة، على صفيحة معدنية في دائرة كهربائية منتجة تيارًا كهربائيًا يمكن قياسه بدقة.
لكن ماذا لو عرَّضنا سطح المعدن لموجات ذات طول موجي طويل أو طاقة قليلة؟ حينها لن تنبعث أي إلكترونات ولن يمر أي تيار في الدائرة مهما كانت شدة الضوء! فسر آينشتاين هذه الظاهرة مستخدمًا أفكار بلانك بأن لكل ضوء ذي طول موجي معين كَمة طاقة محددة، نسميها الفوتون أو جسيم الضوء، حيث يمكن حساب طاقتها بمعرفة طولها الموجي.
فسر آينشتاين الظاهرة كالتالي: الإلكترون داخل المعدن يمكن وصفه بأنه في حفرة لا يستطيع الخروج منها إلا إذا حصل على بعض الطاقة للقفز، والفوتون يمكن أن يمده بهذه الطاقة. لكن الإلكترون يمكنه فقط أن يأخذ طاقة فوتون واحد لا أكثر. لذلك، لا يهم عدد الفوتونات التي تنهمر على الإلكترونات داخل المعدن، بل لا بد أن تكون طاقة الفوتون الواحد كافية لتحرر الإلكترون.
قدم تفسير آينشتاين تَصورًا جسيميًا للضوء، تأكد بعد ظهور تأثير آخر وهو "تأثير كمبتن/Compton effect" الذي يصور بالفعل الفوتونات والإلكترونات كجسيمات تتغير طاقتها ويتحول مسارها بالتصادم!
أدت هذه التجارب والأفكار إلى ظهور مفهوم مهم، وهو الطبيعة المزدوجة للجسيمات الميكروسكوبية أو الصغيرة جدًا. فهذه الجسيمات العجيبة تتصرف في بعض الأحيان كموجات وفي البعض الأخر كجسيمات. قادنا هذا المفهوم في النهاية لاكتشاف معادلة شرودينجر التي استخدمت على نطاق كبير في وصف سلوك كل هذه الأنظمة الذرية والجزيئية بنجاح.
التركيب الذري ونموذج رذرفورد/بور
من جهة أخرى، كان هناك تطور كبير في فهم تركيب المادة الدقيق أو التركيب الذري. فقد تمكَّن النيوزيلندي إرنست رذرفورد (1871-1937) من اكتشاف تركيب الذرة، إذ سلَّط وابلًا من جسيمات ألفا الموجبة الشحنة (هي أنوية ذرات الهليوم) على ذرات الذهب الموجودة في شريحة منه، فاستطاع معرفة هذا التركيب عن طريق فهم التشتت الحادث في جسيمات ألفا.
وجد رذرفورد أن جسيمات ألفا تخترق معظم الذرة بدون أي انحراف، ليستنتج أن الذرة فارغة تقريبًا، إلا أنه وجد جسيمات ألفا تتنافر بشدة في منطقة صغيرة جدًا في المنتصف، وهي النواة الذرية موجبة الشحنة. يعني ذلك أننا لو تخيلنا النواة بحجم كرة صغيرة قطرها سنتيمتر واحد، فستكون الذرة بحجم ملعب كرة القدم!
كذلك اقترح رذرفورد أن إلكترونات الذرة تدور حول النواة الموجبة في مسارات كالكواكب التي تدور حول الشمس!
لكن المعضلة التي واجهت نموذج رذرفورد، هي أن نموذجه للذرة غير مستقر، تبعًا لقوانين الفيزياء الكلاسيكية. فمن المعروف أن الجسيمات المشحونة كهربائيًا وتسير في مسارات دائرية، تشع موجات كهرومغناطيسية ويستتبع ذلك انخفاضًا في سرعتها، فتصغر دائرة المسار حتى يسقط الإلكترون داخل النواة وينهار البناء الذري.
إذًا، لا تستطيع الفيزياء الكلاسيكية تفسير الذرة وتركيبها فيزيائيًا، لأن قوانينها لن تسمح بها! كان هذا بمثابة إعلان لفشل الفيزياء الكلاسيكية في تفسير التركيب الذري المثبت تجريبيًا.
كذلك لم يستطع نموذج رذرفورد تفسير النتائج التجريبية المهمة التي أظهرت أن طاقة الإلكترونات داخل الذرة لها قيم محددة تسمى مستويات الطاقة. يمكننا أن نمثل مستويات الطاقة بطوابق بناية ما، تشغل الإلكترونات طوابق محددة منها، وتكون الطوابق الشاغرة بالإلكترونات هي الطوابق الدنيا (المستويات الأرضية) إذا كانت الذرة غير مثارة، أي ليس لديها طاقة زائدة. إذا اصطدمت الذرة بفوتون، فيمكن لإلكترون أن يأخذ طاقته ليصعد بها. مثلًا، من الطابق الثاني إلى الثالث فيسمى الأخير مستوى إثارة.
لكن لا بد لطاقة هذا الفوتون أن تكون مساوية تمامًا لفرق الطاقة بين الطابقين الثاني والثالث. غير ذلك، لن ينتقل الإلكترون من طابقه. كذلك عندما تكون الذرة مثارة، تميل للعودة إلى الحالة الأرضية، فتبعث بفوتون وينزل الإلكترون في مستوى الإثارة إلى المستوى الأرضي، وتكون طاقة الفوتون مساوية تمامًا للفرق بين طاقة المستويين.
كانت مستويات طاقة الإلكترون في الذرة لغزًا غير مفهوم، إلى أن قدَّم الفيزيائي الدنماركي نيلز بور (1885-1962) عام 1913 نموذجه المهم لتركيب الذرة. فسر بور وجود مستويات الطاقة مستخدمًا أفكار بلانك الرائدة، حيث افترض أن هناك كمية فيزيائية أخرى تكون قيمها دفقات من قيمة محددة.
كانت هذه الكمية الفيزيائية هي العزم الزاوي للإلكترون، التي تعبر عند دورانه حول النواة وتساوي حاصل ضرب كتلة الإلكترون في سرعته في نصف قطر مداره. مع بساطة فرضية بور، إلا أنها فسرت بنجاح كبير مستويات طاقة ذرة الهيدروجين التي ظلت لغزًا لسنوات.
كان نموذج بور وتفسيره لمستويات طاقة الإلكترون خطوة مهمة وملهمة لأعمال عديدة حاولت تطوير ما قدمه، وشكلت في النهاية ما نعرفه اليوم بميكانيكا الكم، وهي الميكانيكا الأساسية التي تصف سلوك جميع الجسيمات الميكروسكوبية.